
Personalisierte Medizin: Vor der Verordnung steht der Test (Teil 5)
Vorgeschriebene oder nachdrücklich empfohlene Gentests
(Autor: Prof. Dr. Theo Dingermann)
Nach wie vor wird restriktiv darüber diskutiert, ob und in welchem Ausmaß genetische Informationen eines Patienten in eine Therapieentscheidung miteinfließen sollen. Man hat sich eingerichtet in der Evidenz-basierten Medizin, die auf der statistischen Auswertung von Daten von Patienten- oder Probanden-Populationen basiert, die entweder mit dem zu testenden Wirkstoff oder mit einem Scheinmedikament, einem Placebo, behandelt wurden. Und all das prospektiv und doppelblind.
Dabei steht „prospektiv“ für die Festlegung auf eine These zum Ausgang der Studie vor Beginn der Studie, die dann entweder bestätigt oder verworfen wird. Das zweite Attribut „doppelblind“ bedeutet, dass weder Therapeut noch Patient oder Proband wissen, ob ein Wirkstoff oder ein Placebo verabreicht bzw. eingenommen wird. Das ist offensichtlich alles andere als personalisiert. In zwei Bereichen wäre es dringend an der Zeit, auch „persönliche“, d. h. genetische Daten in Therapie-Entscheidungen mit einfließen zu lassen: 1. bei erworbenen, Arzneimittelrelevanten genetischen Besonderheiten, und 2. bei ererbten Arzneimittelrelevanten genetischen Besonderheiten. Hier (Teil 5) widmen wir uns dem ersten Fall. Im Teil 6 dieser Serie besprechen wir dann den zweiten Fall.
Die moderne Medizin hält heute Wirkstoff bereit, die eine Zielstruktur adressieren, die nicht zwingend bei jeder möglichen Form ein und derselben Krankheit vorhanden sein muss. Das ist zum Beispiel bei bestimmten Krebsleiden so, und darauf hat man tatsächlich auch konsequenterweise reagiert. Längst reicht beispielsweise die Diagnose „Brustkrebs“ oder „Dickdarm-Krebs“ nicht mehr aus, um eine Therapieentscheidung zu treffen. Heute fragen die Therapeuten nach dem Vorhandensein oder dem Fehlen eines Rezeptors, eines bestimmten Proteins auf der Oberfläche der Tumorzellen oder eines genetischen Fehlers in einer Zellkomponente, die für die Weitergabe von Informationen verantwortlich ist. Nur wenn das Ergebnis der entsprechenden Analyse mit „positiv“ bestätigt wird, wird ein hochspezifischer Wirkstoff eingesetzt, der sich exakt gegen dieses Molekül richtet. Denn nur dann macht der Einsatz dieser oft sehr teuren Medikamente Sinn.
Auf der Homepage des Verbands der forschenden Arzneimittelhersteller wird eine Liste von Wirkstoffen gepflegt, deren Einsatz zwingend oder aufgrund eindrücklicher Empfehlung einen Gentest voraussetzt (https://www.vfa.de/de/arzneimittel-forschung/datenbanken-zu-arzneimitteln/individualisierte-medizin.html). An wenigen Beispielen aus dieser Liste soll die Bedeutung einer arzneimittelbezogenen Diagnostik erläutert werden.
Diese Beispiele stammen aus dem Problembereich Tumortherapie. Hier geht es darum, genetische Veränderungen im Tumor zu diagnostizieren, um mit dieser Zusatzinformation möglichst gezielt und damit möglichst erfolgreich den Patienten behandeln zu können. Die relevanten Mutationen, die als Biomarker nachgewiesen oder ausgeschlossen werden müssen, wurden von den Tumorzellen erworben und bilden einen Teil des Pathomechanismus der Erkrankung. In den meisten Fällen ist der Nachweis bzw. der Ausschluss der Mutation zwingend erforderlich, da die Wirkstoffe, die zur Therapie eingesetzt werden sollen, an stratifizierten Patienten-Kollektiven getestet wurden und die Zulassung ausdrücklich nur in Kombination mit dem Test erteilt wurde.
Bedeutung des Nachweises der Target-Expression.
Beim ersten Beispiel handelt es sich um die beiden rekombinanten Antikörper Trastuzumab (Herceptin®) und Pertuzumab (Perjeta®). Diese beiden Antikörper werden zur Behandlung von metastasierendem Brustkrebs eingesetzt. Die Wirkung beruht auf der Bindung der Antikörper an HER2-Rezeptoren. Durch die Anlagerung der Antikörper wird die Dimerisierung der Rezeptoren verhindert, die Voraussetzung dafür ist, dass der Rezeptor aktiviert wird. Auf diese Weise wird das pathologisch unkontrollierte Wachstum der Tumorzellen blockiert. Ferner markieren die Antikörper die Tumorzellen und machen sie so für das patienteneigene Immunsystem „sichtbar“. Dieses greift nun über spezielle Mechanismen die Tumorzellen an und schickt sie in den kontrollierten Zelltod.
Voraussetzung für den Einsatz dieser Wirkstoffe ist der Nachweis einer Überexpression der HER2-Rezeptoren im Tumorgewebe. Nur bei dieser Gruppe der Mamma-Karzinome macht der Einsatz der Antikörper Sinn, da nur in diesem Fall die Antikörper eine ausreichend große Zahl von Zielmolekülen für die Bindung vorfinden.
Das zweite Beispiel wurde bereits im Teil 2 dieser Serie angesprochen und erläutert. Hier geht es um die beiden rekombinanten Antikörper Cetuximab (Erbitux®) und Panitumumab (Vectibix®), die zur Behandlung des Dickdarm- oder Kolon-Karzinoms zugelassen sind. Beide Antikörper blockieren einen Wachstumsfaktorrezeptor – den epidermalen Wachstumsfaktorrezeptor (EGFR) – auf der Oberfläche der Tumorzellen. Indem sie den Rezeptor besetzen, verhindern die Antikörper, dass die Tumorzellen durch einen Wachstumsfaktor zur ständigen Teilung stimuliert werden. Voraussetzung für den Einsatz dieser beiden Antiköper ist natürlich, dass die Tumorzellen tatsächlich diesen Wachstumsfaktorrezeptor exprimieren, was diagnostisch zu überprüfen ist, bevor die Therapieentscheidung getroffen wird (Nachweis der Target-Expression).
Wie wichtig eine Stratifizierung auf Basis des Nachweises der Expression des für die Intervention relevanten molekularen Targets ist, zeigt der Vergleich von vier fiktiven klinischen Studien, die sich jeweils im Anteil der Patienten unterscheiden, die tatsächlich die Zielstruktur exprimieren (Tabelle 1).
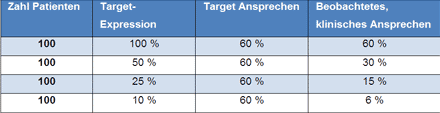
Tabelle 1: Stratifizierung auf der Basis eines molekularbiologisch ermittelten Biomarkers
Jeweils 100 Patienten werden fiktiv behandelt, wobei die Tumorzellen jeweils zu unterschiedlichen Prozentsätzen die Zielstruktur für den Wirkstoff exprimieren. Das Target-Ansprechen wurde mit 60 % angenommen. Das je nach Target-Expression zu erwartende klinische Ansprechen ist in der letzten Spalte ausgewiesen.
Aus diesem einfachen Beispiel lassen sich folgende Schlüsse ziehen:
1. Eine Target-Expression ist für manche therapeutische Interventionen mit zielgerichteten Wirkstoffen ein zwingender Prädiktor für das klinische Ansprechen.
2. Ein schlechtes klinisches Ansprechen bedeutet nicht zwingend, dass der Wirkstoff „schlecht“ ist.
Bedeutung des Nachweises des Ausschlusses oder des Vorhandenseins von aktivierenden Mutationen.
Betrachten wir noch einmal den Einsatz der beiden rekombinanten Antikörper Cetuximab (Erbitux®) und Panitumumab (Vectibix®), die zur Behandlung des Dickdarm- oder Kolon-Karzinoms zugelassen sind. Der Einsatz dieser Antikörper macht, wie man heute weiß, nur Sinn, wenn nachgewiesen wurde, dass das Interventionskonzept nicht durch eine Mutation in einem Molekül der intrazellulären Signaltransduktionskette gestört wird. Bei diesem intrazellulären Molekül handelt es sich um das RAS-Protein, dessen Gen derart mutiert sein kann, dass das „Schalterprotein“ seine Schalterfunktion nicht mehr korrekt ausüben kann, da sich der molekulare Schalter nicht mehr abschalten lässt. Es nützt dann nichts mehr, den Wachstumsfaktorrezeptor mit einem der beiden Antikörper zu blockieren, da diese Blockade durch die permanente Aktivierung einer Signaltransduktionskomponente im Inneren der Zelle funktionell ignoriert wird (Abb. 1).
Abbildung 1 A
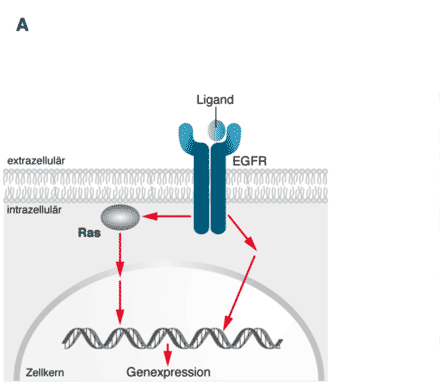
A. Das ungebremste Wachstum einer Dickdarm-Tumorzelle wird unter anderem dadurch gesteuert, dass ein Wachstumsfaktor (Ligand) an einen epidermalen Wachstumsfaktor-Rezeptor (EGFR) bindet, der in der Membran der Tumorzelle steckt. Dieser Komplex aus Ligand und EGFR aktiviert mehrere Signalkaskaden, die letztlich im Zellkern münden und durch Aktivierung der Genexpression die Zelle so programmieren, dass sie sich ungehemmt teilt.
Abbildung 1B
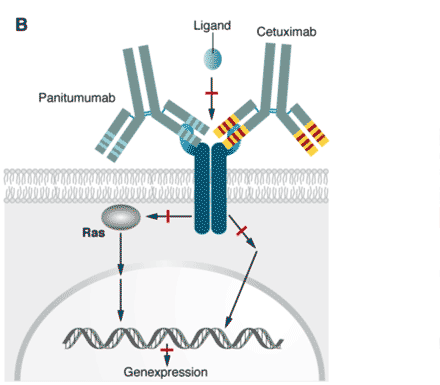
B. Das in [A] beschriebene fatale Geschehen kann unterbrochen werden, indem man Antikörper einsetzt, die an der Wachstumsfaktor-Rezeptor (EGFR) binden und so verhindern, dass der Ligand binden kann. Das ist nicht nur plausibel, sondern das funktioniert tatsächlich auch, so dass der Tumor sein Wachstum einstellt. Zwei solcher Antikörper sind heute als Medikamente zugelassen.
Abbildung 1C
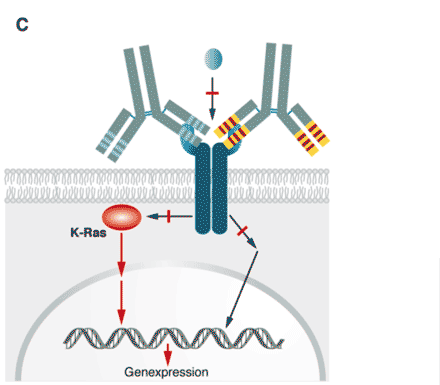
C. Werden die Tumoren zu spät erkannt, können auch Komponenten der Signaltransduktionskaskade sich genetisch so verändern (mutieren), dass sie die Kaskade unabhängig von dem Liganden/Rezeptor-Komplex aktivieren. In diesem Fall haben die Antikörper ihre Wirksamkeit verloren und können das Wachstum nicht mehr stoppen.
Aus diesem Grund erlauben die Zulassungsbehörden den Einsatz der beiden Antikörper Cetuximab (Erbitux®) und Panitumumab (Vectibix®) zur Behandlung eines EGF-Rezeptor positiven Kolon-Karzinoms mittlerweile nur noch dann, wenn durch einen Gentest sichergestellt wurde, dass die Kolon-Karzinomzellen kein mutiertes ras-Gen tragen.
Ein weiteres Beispiel betrifft den recht neuen Wirkstoff Afatinib (Giotrif®). Afatinib ist ein Tyrosinkinase-Inhibitor, der den Signalweg ausgehend von allen homo- und heterodimeren Formen der ErbB-Familie hemmt. Der Wirkstoff bindet irreversibel an die Rezeptoren ErbB1, HER2 (ErbB2), ErbB3, ErbB4 und ist zur Erstlinientherapie nur bei solchen Patienten indiziert, die an einem metastasiertem nicht-kleinzelligen Bronchialkarzinom (NSCLC) erkrankt sind, deren Tumorzellen eine Mutation in Exon 19 (del19) oder Exon 21 (L858R) des EGF-Rezeptors aufweisen. Diese beiden Mutationen sind so genannte aktivierende Mutationen, die ebenso, wie bei der oben beschriebenen Mutation im ras-Gen dazu führen, dass eine Schalterfunktion dahingehend verloren geht, dass der Schalter permanent eingeschaltet bleibt. Afatinib bindet dann an diesen defekten Schalter und inaktiviert ihn irreversibel.
Wie wichtig eine Stratifizierung auf Basis des Nachweises des Ausschlusses einer Aktivierung eines sekundären Targets (eine ras-Mutation beim Einsatz der monoklonalen Antikörper Cetuximab und Panitumumab) oder durch Nachweis der Aktivierung eines primären Targets (eine Mutation in Exon 19 (del19) oder Exon 21 (L858R) beim Einsatz von Afatinib) für die Intervention ist, zeigt der Vergleich von vier fiktiven klinischen Studien, bei denen zwar alle Patienten das primäre und sekundäre exprimieren, wo diese Targets jedoch zu unterschiedlichen Anteilen durch Mutationen aktiviert sind (Tabelle 2).

Tabelle 2: Stratifizierung auf der Basis eines molekularbiologisch ermittelten Biomarkers
Jeweils 100 Patienten werden fiktiv behandelt, wobei die Tumorzellen jeweils zu 100 % die Zielstruktur für den Wirkstoff exprimieren. Für die Antikörper im ersten Beispiel ist dies der epidermalen Wachstumsfaktorrezeptor (EGFR), für das niedermolekulare Afatinib sind es Rezeptoren der ErbB-Familie. Das durchschnittliche Ansprechen der Therapie unter optimalen Bedingungen wird hier jeweils mit 80 % angenommen. Die vier Studiengruppen unterscheiden sich in der Aktivierung des sekundären (im Falle der Antikörper) bzw. des primären Targets (im Falle des Afatinibs). Im Falle der Antikörpertherapie muss die Aktivierung eines sekundären Targets, dem ras-Gen, ausgeschlossen sein, um mit einem klinischen Ansprechen rechnen zu können. Im Fall der Behandlung mit Afatinib muss hingegen das primäre Target (ein Mitglied der ErbB-Rezeptorfamilie) durch eine Mutation aktiviert sein, um mit einem guten klinischen Ansprechen rechnen zu können. Wie man unschwer erkennt, sind die beobachteten klinischen Ansprechraten in den vier Studienpopulationen dramatisch verschieden.
Aus diesem einfachen Beispiel lassen sich folgende Schlüsse ziehen:
1. Eine Target-Expression ist nicht zwingend ein Prädiktor für klinisches Ansprechen.
2. Ein schlechtes klinisches Ansprechen bedeutet nicht, dass der Wirkstoff „schlecht“ ist.





